腐食とは何か
腐食とは、金属が他の物質との接触などで化学反応を起こし、金属表面が消耗(減肉)する現象です。腐食により生成された物質を腐食生成物(サビなど)といいます。
腐食のメカニズム
金属が他の物質と接触したり電圧を受けると、
金属原子から電子が分離される酸化反応(アノード反応)が起こり、金属原子は正の電気を帯びた金属イオンに変わります。
分離した電子は金属表面の他の箇所で、還元反応(カソード反応)により周囲の物質に受け渡されます。

残った金属イオンは周囲に溶け出し、酸素などと結合して腐食生成物(サビなど)になります。
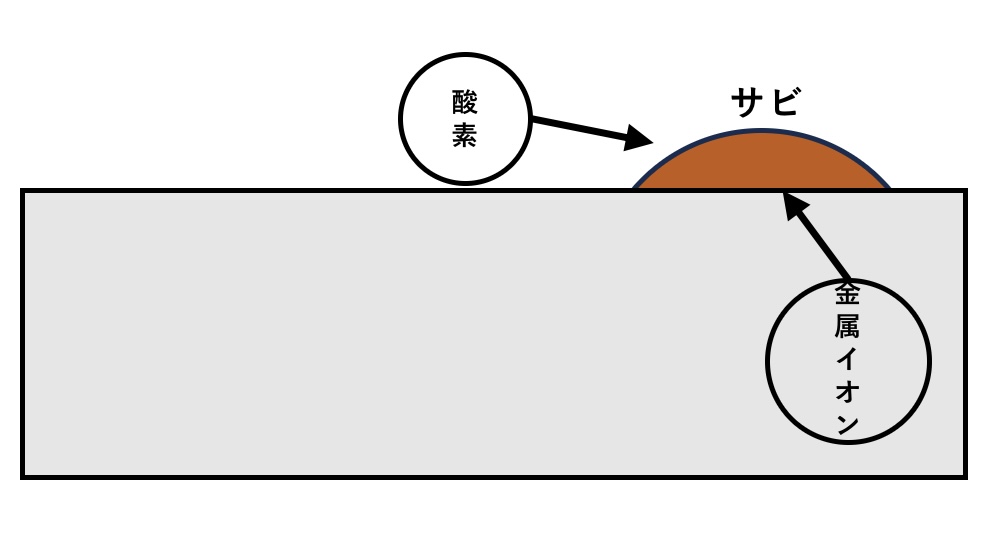
金属原子が金属イオンになり周囲に溶け出す流れを繰り返すことで、金属は徐々に消耗(減肉)します。
腐食は避けられない現象
腐食は避けられない自然現象であり、金属やその他の材料が環境要因によって劣化します。
腐食が進行すると、金属の構造的強度が低下し、機械や構造物が予期せずに故障したり、寿命が短くなるなどの影響が発生します。
これらの影響を最小限に抑えるためには、適切な金属の選択、設計の最適化、そして使用環境の厳格な管理が不可欠です。
覚えておくべき腐食の種類
孔食
孔食(こうしょく)は、金属表面が局部的に孔(あな)が空いたように深く腐食する現象です。
主に、ステンレス鋼やアルミニウム合金など、腐食からの保護作用がある不動態皮膜を生成する金属で起こります。
塩分などの腐食性の高い物質に長期間さらされたり、表面に傷がつくと、不動態皮膜が破壊されます。
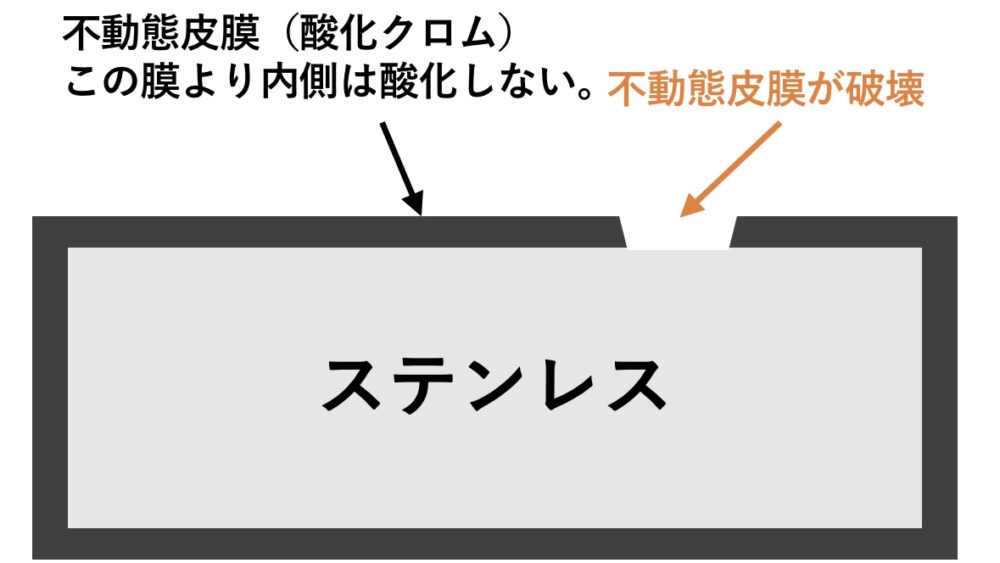
破壊された箇所は、周囲の健全な部分よりも電子を失いやすくなり、局部的に孔が空いたように腐食します。
理論上、酸素が十分供給されれば不動態皮膜は再形成されますが、腐食が進行した箇所は酸素の供給が不十分であったり、腐食性物質の持続的な攻撃により、再形成が阻害されます。
その結果、不動態皮膜が再形成されずに金属が裸の状態で露出し、腐食がさらに進行することになります。
すきま腐食
すきま腐食は、金属と他部品の接合部などの狭い隙間で起こる腐食です。
これらの隙間に液体や湿気が侵入し、周囲と比べて酸素濃度が低下すると、酸素濃度の差によって起電力を生成する酸素濃淡電池が形成されます。また、酸素濃度の低下は不動態皮膜の再形成も阻害します。
酸素濃度が低い隙間側の金属では、酸素が金属原子から電子を受け取る還元反応(カソード反応)が抑制され、隙間外側の金属よりも電子の量が多く(電位が低く)なります。
すると、電子の多い隙間側の金属から、電子の少ない隙間外側の金属へ、電子が移動しようとします。
隙間側の金属原子から電子が分離する酸化反応(アノード反応)が起こり、電子は隙間外側の金属へ流れ、残った金属イオンは金属から放出されて隙間にある別の物質と結合して腐食生成物(サビなど)となります。
イオン化傾向と表面処理
腐食に関連する用語として「イオン化傾向」というものがあります。
イオン化傾向とは、金属が溶液中で陽イオンになろうとする性質(酸化により電子を失う性質)のことです。
このイオン化傾向を利用して金属を腐食から守る表面処理がめっきです。
錫、ニッケルめっき(バリア防食)
錫(すず)めっきやニッケルめっきの場合、鉄よりもイオン化傾向が低い錫やニッケルで表面をコーティングすることで、腐食に強い錫ニッケルが鉄を腐食から守ってくれます。
コーティング内部の金属を外部から完全に遮断できるため、正しく使われれば長期的な保護効果が期待できます。一方で、表面に大きな傷がつくと内部の金属があらわになり、防食性が低下します。
亜鉛めっき(犠牲防食)
亜鉛めっきの場合、鉄よりもイオン化傾向が高い亜鉛で表面をコーティングすることで、先に亜鉛が腐食することで鉄を腐食から守ってくれます(犠牲防食)。
表面の亜鉛が内部の金属より先に腐食することで内部の金属を守る仕組みのため、表面が損傷しても防食効果が機能し続けるというメリットがあります。
おわりに
本記事では、腐食の基本、主要な腐食の種類、そして腐食を防ぐ表面処理技術についてご説明しました。
腐食は避けられない現象ですが、適切な予防措置によりその影響を大幅に減少させることが可能です。亜鉛めっきやニッケルめっきなどの技術を活用し、金属の寿命を延ばし、機能を保持することが重要です。適切な表面処理の選択が、貴重な資源を保護します。

